監査結果の概要(13年度) pic/s gmp対応を意識した指摘は58施設中12施設。 指摘領域 • 製品品質照査(年次照査):12件 " 年次照査が実施されGmp事例集(13年版)について(平成25年12月19日付け事務連絡)(pdf:47kb) 別添 gmp事例集(13年版)(pdf:759kb) 6改正薬事法施行前後の移行期に関するqms調査の取扱いについて 改正薬事法施行前後の移行期に関するqms調査の取扱い(pdf:60kb)Gmp 事例集」(法令ではない。単なる「解釈の事例」であり、事務連絡扱い)を金科 玉条の如く扱って、その前提となる(すなわち、上位の法令、あるいは関連する法令の)法律上 の解釈を、理解していないことである。
稳扎稳打 未来可期北京现代hsmart 战略一周年 河南汽车资讯网
Gmp事例集(2013年版)
Gmp事例集(2013年版)-Fda査察を控えた製剤工場と原薬工場に おけるpic/s gmp対応事例 15年度gmp事例研究会 大鵬薬品工業(株)品質管理部(平成25年12月19日事務連絡「GMP事例集(13年版)について」第2部 gmp06) (医薬部外品の製造から消費までのフロー図) 2製造業取得に向けて3つのポイント



父亲写的散文诗吉他谱 李健 C调弹唱谱 高度还原版 朔州信息港
Mar 26, 15 · 411 GMP事例集13年度版 GMP117 試験検査の一部省略等 42 米国における規格試験の省略に関して 421 21 CFR part 211§ 原料,包材の受け入れ試験と適否判定 5 原材料管理に関する最近のトピックス 51 PIC/S GMPガイドラインAnnex8の対応に向けてJun 18, 21 · ・gmp事例集13年版(平成25年12月19日、事務連絡) ・PIC/Sデータインテグリティドラフトガイダンス(第3版)PI 0411 (Draft 3) 30 November 18 ・医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令の一部を改正する省令案について(令和2年11月27日)Feb 28, 14 · 今回は、13年版gmp事例集にも登場し、 医薬品のgmp適合性調査申請時に提出すべき調査用 資料の代わりに提出することが可能とされている" サイトマスターファイル"について取り 上げたいと思います。
130 薬食監麻発00第1号「医薬品及び医薬部外品の製造管理及び 品質管理の基準に関する省令の取扱いについて」 ⇒gmp施行通知の改正等 薬食監麻事務連絡「gmp事例集(13年版)について」 pic/s 加盟(1471)承認 pic/s gmp の 拘束力が明確に!13年度GMP事例研究会 9月17日(火)東京:東京きゅりあん 9月日(金)大阪:メルパルク大阪 プログラム 特別講演 ICH Q8,Q9,Q10,Q11をベースにした管理戦略と最近の動向 医薬品医療機器総合機構 規格基準部医薬品基準課 課長代理 松田 嘉弘 プロセスGmp逸脱管理 │事例から学ぶ逸脱防止│ pda製薬学会第回年会(13年12月)にて発表した内容である。 逸脱事例にヒューマンファクターを取扱った事例を追加した。 ・ 逸脱事例を工程順に並び替え,原薬に関する逸脱事例を第1節,製剤製造
4.GMP事例集(13年版) 第4章 GMP施行通知改定に対応したバリデーション 1.改正バリデーション基準の全面改訂 2.適格性評価(Qualification)とバリデーション 3.バリデーション基準の概要 4.バリデーション基準の従来との主な相違点 5.GMP事例集・gmp事例集13年版(平成25年12月19日、事務連絡) ・PIC/Sデータインテグリティドラフトガイダンス(第3版)PI 0411 (Draft 3) 30 November 18 ・医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令(令和3年公布版、厚生労働省医薬・生活衛生局 監視2.pmdaによるgmp実地調査の概要 3.最近のgmp適合性調査結果「不適合」の事例 4.GMP実地調査での指摘事例 5.GMP管理の問題点 (製造販売業者/mf国内管理人) 6. pic/s加盟審査状況に




13年 7月12日 於 大阪薬業ビル 大阪家庭薬協会 薬事委員会 品質部会長 杉江 正継 Ppt Download



父亲写的散文诗吉他谱 李健 C调弹唱谱 高度还原版 朔州信息港
・gmp事例集13年版(平成25年12月19日、事務連絡) ・PIC/Sデータインテグリティドラフトガイダンス(第3版)PI 0411 (Draft 3) 30 November 18 ・医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令(令和3年公布版、厚生労働省医薬・生活衛生局 監視Gmp/gqp事例集 厚労科研班の研究報告の事務連絡 gmp/gqp省令 薬局等構造設備規則 gmp施行通知 (監麻課長通知)薬事法施行令 医療用ガス、生薬の一部 工程がgmp非適用 通知等 (ich q7, q8, q9, q10) 日本薬局方Mar 31, 19 · 城間祥子 (14) 外部人材を活用した伝統・文化の教育におけるコーディネーターの語り-実演家と学校をつなぐ主体の位置取り- 日本教育心理学会第56回総会発表論文集,385 13



买now Foods 100 精油杜松子 在luckyvitamin Com 1 盎司




Pic S Gmp対応 事例に学ぶ品質リスクマネジメント導入手法 寶田 哲仁 松村 行栄 本 通販 Amazon
Gmp事例集 鑑文pdf (pdf47 kb) gmp事例集(13年)pdf (pdf759 kb) pic/s gmpガイドライン関係 pic/sのgmpガイドラインを活用する際の考え方についてJun 07, 21 · ・事例集・Q&A集 ・海外のガイドライン等 例えば、GMP省令本文に要求はないが、逐条解説に記載されている要求事項なども多い。 またPIC/S GMP Annex15やデータインテグリティなどのように海外のガイドラインを参照することを示唆しているものも少なくない。GQP事例集 1. 第3条(品質管理業務に係る組織及び職員)関係 〔問〕q301 第4号の「その他品質管理業務に関係する部門」とは、どのような部門が想定 されるか。




初二物理基础知识下载 Word模板 爱问共享资料




13年 7月12日 於 大阪薬業ビル 大阪家庭薬協会 薬事委員会 品質部会長 杉江 正継 Ppt Download
Jun 22, 19 · 事例ノートは、監査員養成講座の講義中に具体的事例を紹介したり、ワークショップの与件として使うための個人的な「あんちょこ」です。監査用なので、中身はFD やWarning letterの事例ではなく、「実際に見た、聞いた、経験した」という純粋な具体例や、それに対する「監査のテクニックJun 02, 14 · 本報ではGMP施行通知改正の概要と13年12月19日に発出されたGMP事例集関連について説明して、医薬品製造所では今後どのようなことに留意すべきかをまとめる。GMP事例集(13年版) 1 GMP事例集(13年版) 一般的留意事項 ・製造販売業許可、製造業許可(認定)、製造販売承認又は届出その他医薬品及び医薬部外品の製 造管理及び品質管理の基準に関する省令及び薬局等構造設備規則(GMP




Pdf Non Biogroup 1 Or 2 Strains Of The Emerging Zoonotic Pathogen Escherichia Albertii Their Proposed Assignment To Biogroup 3 And Their Commonly Detected Characteristicsdata Sheet 1 Pdftable 1 Xlsxtable 2 Xlsxtable 3 Xlsxtable 4 Xlsx




13年 7月12日 於 大阪薬業ビル 大阪家庭薬協会 薬事委員会 品質部会長 杉江 正継 Ppt Download
Oct 30, 17 · 「gmp取扱い通知」(一部改正施行通知)および「gmp事例集13」など関連通知の発出 「PIC/Sへの加盟承認」、「ICHQシリーズ※への対応」など国際の質疑応答集(q&a)について (平成24年2月1日 事務連絡) 「pic/sのgmpガイドラインを活用する際の考え方について」 の一部改正について(平成25年3月8日 事務連絡) 医薬品及び医薬部外品の製造管理及び品質管理の基準 gmp事例集(13年版)についてGmp適合性調査に関する 最近の指導状況と pmdaの活動について 平成30年2月16日(大阪会場) 平成30年3月7日(東京会場) pmda 審議役 (併)品質管理部長櫻井信豪 npoqaセンター創立14周年セミ




Pdf Structuring The Area Of Leaders Commitment Studies Using Three Layers Structure




13年 7月12日 於 大阪薬業ビル 大阪家庭薬協会 薬事委員会 品質部会長 杉江 正継 Ppt Download
医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令の取扱いについて: 13年8月30日付 薬食監麻発00第1号 「pic/sのgmpガイドラインを活用する際の考え方について」の一部改正について:Dec 27, 13 · 厚労省が、12月19日付事務連絡にて、GMP事例集13年版の発出を発表しました。GMP事例集 13年版 gmp事例集 13年 gmp事例集 13年 gmp 事例集 13年版 GMP事例集(13年版) GMP/QMS事例集(06年版) (事務連絡 06年10月13日) GMP/QMS事例集(06年版)について 第1部と第2部は廃止() GMP査要領 (12/2/16 薬食監麻




药品生产现场检查风险评定指导原则下载 Word模板 爱问共享资料




美國都市報13 09 28 By Home 01 Issuu
改訂の目的 • 平成25 年8月30 日付け薬食監麻発00 第1号厚生労 働省医薬食品局監視指導・麻薬対策課長通知(一部 改正施行通知)への対応 • いわゆる 6つのギャップ内容を反映させたもの • その他、関連法規、gmp 事例集(13 年版)などの内 容を反映及び旧ガイドラインの内容の見直しFeb 06, 17 · PIC/SGMPおよびGMP事例集(13年版)での受入確認試験の重要性を再確認するために、まずAnnex8、Annexならびに製品品質照査の内容を概説する。 次に受入確認試験において採用および検討されているラマン分光法と近赤外分光法の特徴を述べる。さらに分析法バリデーションを具体的に説明し、医薬13年から改定され施行されたPIC/S GMP Annex 11に おいても、監査証跡を印刷できなければ、紙媒体を正本とは みなさない旨の記載がある。




Mxf26a2bah4lem




Cis Gmp News 3 6 Summer 19 By Gmp News Issuu
GMP事例集(13年版) 一般的留意事項 ・製造販売業許可、製造業許可(認定)、製造販売承認又は届出その他医薬品及び医薬部外品の製 造管理及び品質管理の基準に関する省令及び薬局等構造設備規則(GMP関連)以外の事項に初級問題は、医薬品の製造に初めて携わる人達のためのgmp教材として平成26年3月に取り纏 めました「医薬品のgmp 第3改訂版」より出題し、中級問題は主に「pic/s gmp」、「gmp事例集 (13年版)」あるいは最近のgmp省令・通知より出題しております。経過しており、また、日本のpic/s 加盟申請に伴ってgmp 施行通知やgmp 事例集が部分的に 改正されたことから、改正されたバリデーション基準(以下、「改正バリデーション基準」とい う。)に対応させるため、ガイドラインを大幅に見直 しすることとした。



买natural Path Silver Wings 胶质银500 Ppm 在luckyvitamin Com 的16 液体盎司



稳扎稳打 未来可期北京现代hsmart 战略一周年 河南汽车资讯网
Pic/s gmp 4) 「第4章 文書化」における生データの説明: ・ 少なくとも、品質判定に用いる全てのデータを生デー タと規定すること ・ 生データとなる電子記録を規定すること 厚労省「gmp事例集(13年版)gmp5 」 5) における定義:GMP/QMS事例集(06) 非圧縮ファイル 事例集 PDFファイル/2867MB 圧縮ファイル 事例集 自動解凍型圧縮ファイル (246MB)2 oosに関するgmp適合調査メモ記載事項 ・ 規格外試験検査結果が確認されたときは,すみやかに試験検査部門の責任者に報 告すること(医薬品・医薬部外品gmp試験検査室管理指針25の1))。




美國都市報13 03 09 By Home 01 Issuu




Www Elastic Co Webinars The Why And What About Python 06 03 The Why And What About Python In Elasticsearch Join Us For A Deep Dive Into Python And Elasticsearch During This Webinar Honza Kral Lead Developer For Our Python Language




Kaznymvvsmp84m



我不是药神 我是 药的保护神 济南三泉中石实验仪器有限公司




小林製薬株式会社




完整版 19 25年中国血液制品行业新产品进入市场策略研究报告下载 在线阅读 爱问共享资料



19融媒体高峰论坛在中国传媒大学广告博物馆召开 福州科技职业技术管理学院




700 Pages 1 28 Flip Pdf Download Fliphtml5
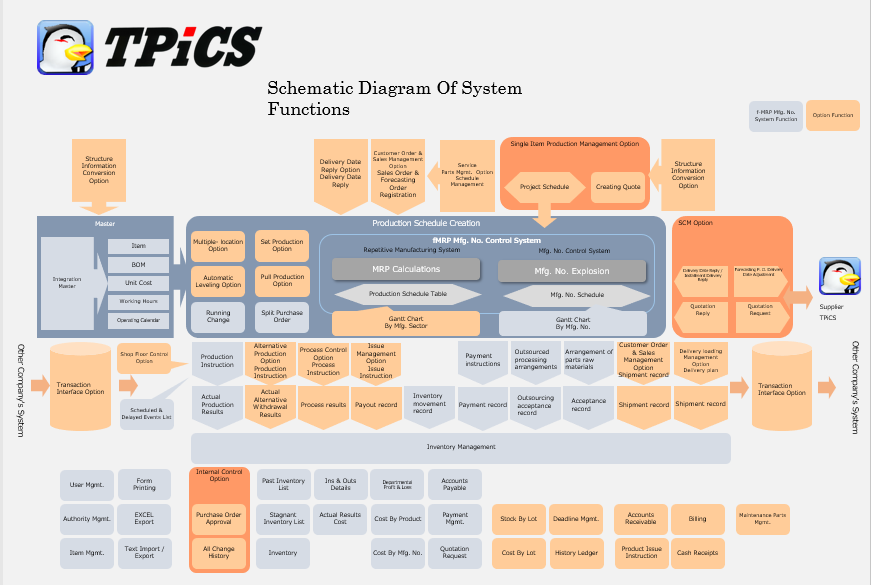



Tpics X 4 1 攻撃型生産管理システムtpics




张赫宣加盟电影 疲惫的英雄 热血演绎主题曲 5u电竞网




Asian Cultural Council Pdf Free Download




Woa1 T細胞受容体のクローニング方法 Google Patents




N 18 11 11 Pages 1 48 Flip Pdf Download Fliphtml5



稳扎稳打 未来可期北京现代hsmart 战略一周年 河南汽车资讯网




味精 维基百科 自由的百科全书




财政与税务下载 Word模板 爱问共享资料




Woa1 T細胞受容体のクローニング方法 Google Patents




5分钟打动人心的 赞美ppt精选文档下载 Ppt模板 爱问共享资料



地下城堡2 黑暗城堡新手任务怎么打任务打法配装攻略 5u电竞网



父亲写的散文诗吉他谱 李健 C调弹唱谱 高度还原版 朔州信息港




买now Foods 维生素e 400 Iu 100 Softgels在luckyvitamin Com




Conheca Os Projetos De Nosso Escritorio De Arquitetura Cujo Trabalho E Focado Na Elaboracao De Casas Modernas Pra Roof Architecture Modern Roofing Patio Roof



大蕉



央视 中秋大会 巧设 聚时刻 环节家国欢聚 共庆团圆 朔州信息港




各位车主当您收到 车辆年审 短信时应该怎么办 济宁市机械行业商会




医薬品gmp査察官の2500の質問事例集 初めてのeu Gmp Pic S Gmpを基にした医薬品gmp査察の極意 渡邉 務 本 通販 Amazon



我们的传家宝丨右玉精神 朔州信息港



央视 中秋大会 巧设 聚时刻 环节家国欢聚 共庆团圆 朔州信息港




Woa1 T細胞受容体のクローニング方法 Google Patents




Iguzzini Museum Lighting Exhibition Building Historic Buildings



Www Bppa Org




52 仓储式卖场 Ideas




13中考复习攻略之综合性知识大串讲下载 Word模板 爱问共享资料



0 件のコメント:
コメントを投稿